卵母细胞冷冻保存技术新进展
【摘要】卵母细胞的冷冻保存已经成为女性生殖力保存的一个重要方式,在人类辅助生殖领域中起着关键的作用。近几年,卵母细胞冷冻保存技术的研究有了很大的突破,在诸多方面都提出了一些新技术与新方法,主要包括冷冻方法、保护剂种类、保护剂添加与去除的方式以及卵母细胞质量的评价等,其中微流体装置不仅用于保护剂的连续添加和去除,还能用于细胞的玻璃化冷冻保存,同时细胞质量评价技术的优劣直接会影响胎儿的发育,甚至成人的健康。因此,微流体技术与科学的质量评价方法可能是未来卵母细胞冷冻保存研究的重要方向。
卵母细胞冷冻保存一直是辅助生殖领域一个备受关注的课题,已经成为了女性生殖力保存的一个重要工具,可以克服胚胎保存所引起的伦理道德以及法律上的问题,为那些接受放疗、化疗或由于其他病理原因而不能生育的女性提供妊娠的机会。到目前为止,人们已经成功地冷冻保存了多种动物的细胞和组织, 比如血细胞、精子、胚胎、皮肤、肝细胞、胰腺组织等。然而卵母细胞的冷冻保存效率还远低于其他细胞,其原因可能是卵母细胞体积大,含水量高,脱水过程比较复杂, 同时细胞膜的结构与渗透性不同于其他细胞, 对冷冻损伤较敏感。为了最大程度地降低低温损伤并提高其冷冻后的复苏率和发育能力,近年来人们对细胞冷冻保存的各个方面做了大量的探索和研究工作,也提出了很多新技术和新方法。众所周知,细胞和组织冷冻保存一般包括下述步骤: ① 低温保护剂的添加; ②细胞的冷冻保存; ③ 细胞的复温融化(解冻); ④ 保护剂的去除(洗脱)。每一步操作都有可能导致细胞的损伤,甚至死亡。本文就如何提高卵母细胞低温保存效果的研究中所出现的新技术和新方法进行综述, 以期为卵母细胞冷冻保存技术的研究和改进提供更多的参考。
1 冷冻保存方法
卵母细胞的冷冻保存主要有慢速冷冻和玻璃化冷冻2种方法。玻璃化冷冻是指液体在降温过程中转变为非晶态的固化过程,可以避免胞内、外冰晶的形成对细胞所造成的损伤。大量研究已证明,玻璃化冷冻保存的效果明显好于慢速冷冻,是目前公认的一种有效的细胞冷冻方法。实现玻璃化通常有2条途径,一条是极大地提高冷却速率,另一条是增加保护剂的浓度。但高浓度的保护剂会对卵母细胞的活性产生毒性损伤和渗透损伤,降温速率的提高有利于胞内、外溶液玻璃化程度的增加,同时可以降低保护剂的浓度, 所以设法提高冷却速率是卵母细胞玻璃化冷冻保存研究的重点之一。
1.1 微滴法
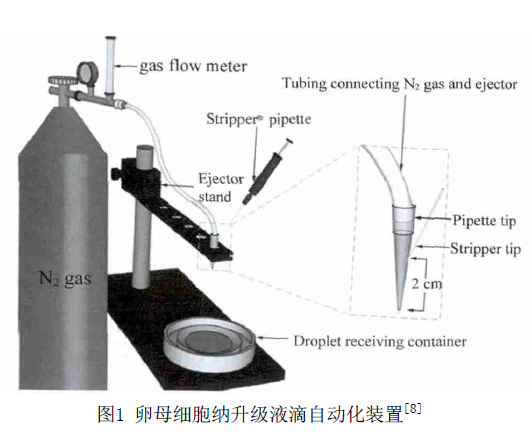
微滴法是最早被提出的一种玻璃化冷冻方法,已经广泛应用于卵母细胞的冷冻保存。该方法操作简单,不需要任何载体,但同时也存在诸多缺点,比如对移液管的操作技术要求较高、无法保证液滴大小的均匀性以及很难控制液滴的体积<1 l等,这些因素都限制了细胞的升降温速率,不利于细胞的玻璃化保存。因此,为了弥补以前微滴法操作的不足,Zhang等[8]提出了一个用于卵母细胞冷冻保存的可连续产生纳升级液滴的自动化装置,如图1 所示。该装置主要有氮气(N2) 罐、喷射器、移液器、带有筛网的液氮池等组成, 其中喷射器是该装置的关键。首先通过移液器将加载完保护剂的卵母细胞注入到喷射器中,然后在N2的作用下将纳升液滴包裹的卵母细胞直接喷入带有筛网的液氮池内,液滴尺寸的大小通过N2的流速来控制。实验结果表明: 小鼠卵母细胞经该系统处理后保存,其成活率为89.9%,细胞回收率为83.2%,同时卵母细胞的卵裂率可达到96%,明显高于对照组(88.6%),但是细胞的囊胚率(26.0%)却低于对照组(49.4%)。
1.2 冷冻载体法
冷冻载体是冷冻保存时承载细胞的物体或装置。卵母细胞玻璃化冷冻时,不同冷冻载体具有不同的冷却速率。目前已经用于卵母细胞冷冻保存的冷冻载体有开放式麦管(OPS)、固体表面(SSV)、冷冻环(Cryoloop)和Cryotop等。这些冷冻载体的应用明显提高了冷却速率,实现了卵母细胞的玻璃化保存,但是冷冻效果仍不太理想,冷冻保存后卵母细胞的卵裂率和囊胚率不高。比如Kuwayama等通过实验比较了OPS 和Cryotop 2 种冷冻载体对人MⅡ期卵母细胞的玻璃化保存效果,结果表明由于Cryotop上的溶液体积远小于OPS上的溶液体积,导致前者的降温、复温速率远高于后者,所以Cryotop法冷冻保存后卵母细胞的卵裂率和囊胚率分别为59.5% 和22.9%,明显高于OPS 法的47.7%和7.4%,这也说明了Cryotop法更适合于人卵母细胞的低温保存。
为了改善卵母细胞玻璃化冷冻保存的效果,研究者提出了一些新的技术和方法。Zhou等提出了一种基于微通道传热的细胞玻璃化冷冻装置,该装置主要有上下2层铜片和一个超薄的细胞固定框组成,细胞固定框夹在2层铜片中间, 铜片的外表面刻蚀有在冷冻与解冻过程中允许工作流体(液氮或热水)流通的平行微通道阵列。该作者通过模拟研究了该系统外部传热系数的大小以及传热系数、样品厚度对冷冻速率的影响, 结果表明: 该装置在冷冻和复温过程中均可获得超高的外部传热系数[>104 W/(m2•K)],当传热系数高于104 W/(m2•K)时,对于厚度为1 mm的样品其冷冻速率>4 000 ℃/min,当厚度为50 m时,冷冻速率甚至可以超过106 ℃/min。之后,苏风民等将薄液膜蒸发方式与液氮低温冷却过程相结合提出了一种基于薄液膜蒸发的超高速冷冻方法,并自行设计搭建了薄液膜蒸发冷冻实验台。该装置中的冷冻载体由2 片9 mm × 9 mm 的铜板组成,铜板的厚度为50 m,2片铜板利用双面胶粘接,在中间形成一个5 mm × 5 mm × 0.12 mm 的空间,用于存放细胞悬浮液。实验中, 用去离子水代替细胞悬浮液,将冷冻载体的温度从10 ℃降到-180 ℃,并与池式沸腾冷却对比。实验结果表明: 池式沸腾冷却过程的平均降温速率为6 904 ℃/min,而液氮薄液膜蒸发冷却过程的平均降温速率为148 052 ℃/min,是前者的21 倍。因此, 这些装置都显著提高了降温速率,缩短了细胞通过冷冻温度危险区的时间,但是关于这些装置在卵母细胞冷冻保存方面的具体应用还未见报道。
2 冷冻保护剂
生物材料的低温保存都离不开冷冻保护剂,卵母细胞也不例外,合理地选择和配制冷冻保护剂对卵母细胞的玻璃化保存至关重要。目前保存卵母细胞常用的冷冻保护剂主要有甘油(GL)、二甲基亚砜(Me2SO)、乙二醇(EG)、丙二醇(PROH)等,其作用机制为在溶液中容易与水分子发生水合作用,使溶液黏性增加,从而弱化了水的结晶过程,达到了保护的目的。实际上,单一保护剂存在很多问题,比如保护剂的化学毒性会影响细胞的活性,所以寻找一种高效率、低毒性的新型冷冻保护剂来改善卵母细胞冷冻保存的效果是研究者努力的一个方向。Matsumura和Hyon发现了一种新型的低温保护剂──羧化-聚赖氨酸(COOL-PLL),其毒性小,同时可以抑制细胞在冷冻与解冻过程中的冰晶生长。之后, Watanabe 等首次尝试将COOL-PLL 用于卵母细胞的冷冻保存, 他们将COOL-PLL 和EG 作为冷冻保护剂, 利用Cryotop装置玻璃化冷冻保存了小鼠的卵母细胞。实验结果表明: 经EG 和PLL 组合处理的细胞冷冻后成活率都超过90%,其中浓度方案为体积分数20% EG +10% PLL 与体积分数15%EG+15%PLL的卵母细胞发育能力[(78.8±5.8)%、73.6±5.8)%]要高于体积分数1 0 % E G + 2 0 % P L L 与体积分数30%PLL的组合[(42.9±5.2)%、(3.4±2.0)%],同时体积分数20% EG +10% PLL 的浓度下细胞的发育成功率(46.2%)明显高于对照组(体积分数30%EG)的34.8%,所以保护剂COOL-PLL对冷冻保存小鼠卵母细胞是有效的。纳米低温保护剂是将纳米颗粒添加到传统的冷冻保护剂中形成一种新型冷冻保护剂。吕福扣等认为,纳米颗粒的添加能够改变冷冻保护剂溶液的冰晶成核温度,促进冰晶成核,减少了溶液结晶量,同时也改变了冰晶的属性,有利于细胞的低温保存。
李维杰等尝试将纳米低温保护剂应用于卵母细胞的玻璃化冷冻保存,将不同粒径的羟基磷灰石(HA)纳米颗粒添加到冷冻保护剂中,使用Cryotop 法对MⅡ期的猪卵母细胞进行玻璃化保存,研究了纳米低温保护剂对猪M Ⅱ期卵母细胞的冷冻效果。冷冻保护剂中加入粒径为20 nm 与40 nm 的纳米颗粒时卵母细胞的成活率分别为(83.1±10.0)%、(83.4±11.8)%,明显高于未添加纳米颗粒的对照组[(71.3±6.0)%]。同时,利用DSC进一步探讨了纳米低温保护剂的保护机理,添加纳米颗粒后,冷冻保护剂溶液的结晶焓会显著减低,由对照组的145.7 J/g减低至30 J/g左右,防止了冷冻时冰晶的生成及复温时的再结晶现象,从而避免了冰晶对细胞的机械损伤。一些多糖类物质也常被用作细胞的冷冻保护剂,如蔗糖、葡聚糖、海藻糖等, 其中海藻糖是近些年发现并开始广泛应用的一种新型非渗透型冷冻保护剂。Eroglu 等研究了不同浓度的海藻糖(0.15 mol/L、0.5 mol/L)在不同添加方式下对人卵母细胞的保护作用,将卵母细胞分为3组,胞外海藻糖组(0.5 mol/L)、胞内、外海藻糖组(胞内0.15 mol/L,胞外0.5 mol/L)及不添加海藻糖的对照组,胞内的海藻糖通过微注射的方式添加,然后细胞在1 ℃/min的降温速率下慢速冷冻至不同温度(-15 ℃、-30 ℃、-60 ℃)并保存,然后在室温下复温并检测细胞的成活率。实验结果表明: 胞内、外海藻糖组的卵母细胞在-15 ℃时的成活率为63%,明显高于对照组(13%)和胞外海藻糖组(22%),在-30 ℃和-60 ℃时的成活率分别为53% 和66%,更是高于对照组和胞外海藻糖组,因为对照组和胞外海藻糖组细胞在-30 ℃和-60 ℃时几乎全部死亡。
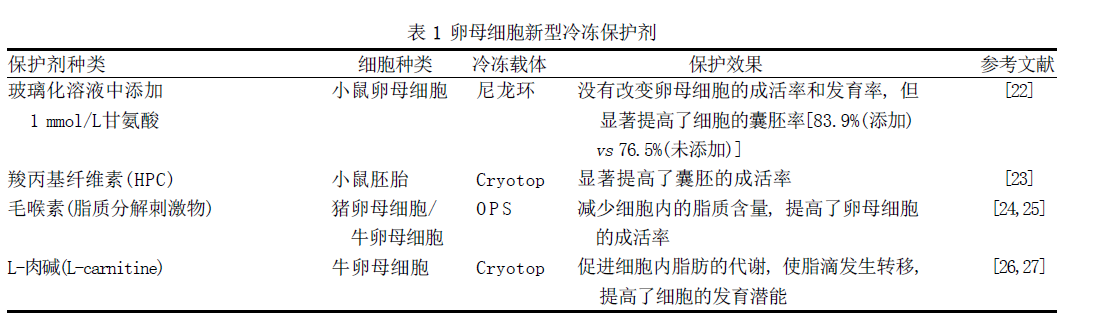
除了上述一些典型的冷冻保护剂外, 还有很多用于卵母细胞冷冻保存的新型保护剂, 如氨基酸类等, 其具体信息如表1 所示。
3 冷冻保护剂添加与去除方式
在卵母细胞冷冻保护剂的添加与去除过程中,细胞渗透压的剧烈变化和保护剂自身的化学毒性可能会对细胞造成渗透损伤和毒性损伤。为了减小这种损伤,有必要对冷冻保护剂添加与去除方案进行优化。目前临床上卵母细胞冷冻保护剂的添加和去除通常采用多步法和离心法。与一步法相比,多步法对细胞的损伤会小很多,但多步法操作步骤繁琐,在溶液间转移的次数也不可能太多,从而导致细胞在高浓度保护剂中暴露时间过长,同时离心法去除保护剂会造成约30% 的细胞丢失率。为了弥补原有方法的不足,提高卵母细胞低温保存的效果, Heo等提出了基于微流体技术的卵母细胞冷冻保护剂添加和去除装置,实现了冷冻保护剂的连续性加载和去除。该微流体装置由2 层聚二甲基硅氧烷(PDMS)制作而成,包括溶液混合通道、卵母细胞操作腔体、细胞出入通道以及细胞控制微阀等。溶液混合通道呈蛇形排列,总长度为2 cm,卵母细胞操作腔体的尺寸为900 m × 600 m ×200 m(长×宽×高),如图2所示。实验中,首先将卵母细胞通过细胞出入通道放入细胞操作腔体内,然后开启配有1 ml注射器的微注射泵,分别将基础液和1.5 mol/L PROH注入微混合通道,两股流体在通道中扩散混合完全,再流过细胞操作腔,实现对卵母细胞冷冻保护剂的连续加载,并用带有高速摄像机的显微镜观察记录卵母细胞体积的变化。实验结果表明: 该装置能够实现多种保护剂加载方案,在不同的方案下,卵母细胞冷冻保护剂的添加时间都<15 min,并且细胞的体积变化都<10%。

利用微流体装置添加和去除冷冻保护剂, 显著减小了对卵母细胞的渗透损伤, 但处理时间仍然过长, 冷冻保护剂会对细胞造成毒性损伤,同时处理的效率较低。为此,Karlsson等[30]尝试对现有的分步法添加和去除方案进行优化,他们引入了毒性成本函数(toxicity cost function),并利用Nelder-Mead单纯型算法对不同温度下冷冻保护剂Me2SO 分步添加到小鼠卵母细胞的过程进行了优化,找到了一组最优的添加方案,进一步提高了小鼠卵母细胞的低温保存效果。实验结果表明: 30 ℃时,两步法完成1.5 mol/LMe2SO的添加时间仅需2.5 min, 其中第一步将卵母细胞暴露在1.404 mol/L Me2SO与含牛血清蛋白NaCl溶液中2.4 min,第二步暴露在1.5 mol/L Me2SO的等渗盐溶液中8 s,冷冻后细胞的发育率和囊胚率分别为92% 和88%, 与细胞未处理对照组(96%、93%)基本一致。说明使用低渗保护剂稀释液,冷冻保护剂的加载时间会明显缩短,而且不影响卵母细胞的发育率和囊胚率。此外,文中还利用该算法优化了冷冻保护剂PROH 分步添加到人卵母细胞的方案,首先在1.4 mol/L PROH 与NaCl 的低渗溶液中暴露1.3 min,然后在1.5 mol/L PROH的等渗溶液中暴露4 s。
4 卵母细胞质量的评价
冷冻后卵母细胞质量的好坏将直接影响细胞的受精率、胚胎的存活、胎儿的发育甚至成年后的健康问题。因此,如何评价并选择高质量的卵母细胞将成为辅助生殖技术和克隆技术面临的一个关键问题。目前对卵母细胞质量评价的技术主要有非侵袭性技术与侵袭性技术,非侵袭性技术是利用显微镜对不同发育阶段卵母细胞形态的显微结构(纺锤丝、透明带等)以及后期的发育能力进行观察判断,它是一种无损分析技术,不会对卵母细胞造成损伤,不影响细胞的进一步发育; 侵袭性技术主要以测定细胞内一些物质成分( A T P 含量、钙含量、蛋白组分、DNA 等)及量的变化为手段,实现定量的、准确的质量评价,但这是一种破坏性的评价方法,会对卵母细胞造成不可逆损伤,测定后的细胞失去了进一步发育的能力。与侵袭性技术相比,非侵袭性技术更适合应用于辅助生殖领域。近些年,研究者也提出了一些新的非侵袭性方法,比如Bogliolo等利用拉曼显微光谱学(RMS)分析比较了3 种不同条件下(玻璃化冷冻、暴露于冷冻保护剂、新鲜)的绵羊卵母细胞透明带上蛋白质结构与糖类组分的变化。该研究表明,与另外2种条件下的卵母细胞相比,玻璃化冷冻的卵母细胞透明带上蛋白质二级结构发生了明显的改变,折叠含量增加,螺旋含量减少,同时糖类组分也有明显的变化,然而,暴露于冷冻保护剂的卵母细胞透明带上的分子成分并没有明显变化。之后,有研究者也使用同样的方法对其他种类的卵母细胞质量进行了评价,证明了拉曼显微光谱技术作为一种非侵袭性技术,对卵母细胞质量的评价是有效的。
5 总结与展望
与冷冻胚胎相比,卵母细胞的冷冻保存在法律上和伦理上都具有较大的优势,在辅助生殖技术(ART)中起关键作用。为了提高卵母细胞玻璃化冷冻保存的效果,研究者在冷冻装置、保护剂种类、保护剂添加和去除方式等方面做了大量的研究,并针对性地提出了一些新的技术和方法。这些新的方法和技术可能会给未来生物材料的低温保存带来新的突破,甚至是可冷冻保存一些大的细胞、组织以及器官。然而,想要实现卵子库建立的产业化,卵母细胞冷冻保存技术的研究还任重而道远,仍存在很多不足: ① 不同发育阶段的卵母细胞其细胞膜的渗透性是不一样的, 到底冻存哪个阶段的细胞效果最好,目前仍没有一个明确的结论; ② 微流体技术的应用实现了细胞冷冻保护剂的连续性加载与去除, 但如何实现温度、加载时间、溶液浓度变化及细胞体积变化的实时同步监测仍然是个难点; ③ 一些新型的冷冻载体从根本上降低甚至避免了细胞被污染的风险,为临床冷冻器械的研发奠定了基础,但与传统的冷冻载体相比, 整个冻存系统的结构与操作都比较复杂,在实际应用中需要不断地优化和完善; ④卵母细胞质量的评价方法过于单一, 大多数只是观察卵母细胞的显微结构或检测蛋白质、糖类等含量的变化,单一的评价方法不能选出高质量的卵母细胞,从而影响胎儿的发育,甚至成人的健康。有报告指出,含滑面内质网聚集体(smooth endoplasmicreticulum aggregates)卵母细胞受精发育来的183个婴儿中,只有171个婴儿健康,出现畸形的可能原因是卵母细胞内脂类的形成导致的。因此,对于卵母细胞质量的评价应该将定性与定量相结合,从细胞内的蛋白质、脂类、DNA 等多方面的检测入手,建立全面、完善的评价标准。




